突破生物材料学认知:科学家研发水分子驱动薄膜新方式,可用于生物接口快速成型和原位成型

https://mp.weixin.qq.com/s/yBKc9geVr9BRsxtz5nIbaQ
突破生物材料学认知:科学家研发水分子驱动薄膜新方式,可用于生物接口快速成型和原位成型

https://mp.weixin.qq.com/s/yBKc9geVr9BRsxtz5nIbaQ
胡本慧教授合作发表《Nature》:遇水骤缩仿生膜实现生物接口标准化
主动健康和重疾管理的需求使生物电子受到临床工作者的广泛关注,生物电子的可植入化和低功耗化弥补了众多影像设备无法长程在体采集信号的短板。然而,体内器官组织不仅尺寸形貌各异,心脏等器官还时刻处于周期性搏动中,导致电子设备与生物组织的接口无法标准化。仅依赖增强器件与组织的界面黏附能可能导致黏附损伤和增加手术复杂度,且在不规则组织表面仍难以形成稳定的共形贴附。
针对上述问题,来自南京医科大学的胡本慧团队与新加坡南洋理工大学陈晓东团队等合作,提出了一种超收缩聚合物主动包裹组织,快速原位形成生物接口的策略。该研究突破了现有生物材料的局限,发展了一种新的驱动薄膜迅速收缩的方式:水分子驱动。不同于聚焦超声、热、光等驱动方式,水驱动不仅生物安全,且可以充分利用体内组织液原位快速形成稳固生物接口。并且接口在收缩成型后依然保持与体内组织相近的低模量(~100 kPa)和高可拉伸率(~600%),显著简化了手术植入操作,因此可以在内窥镜下通过微创手术完成植入。该研究成果以Water-responsive supercontractile polymer films for bioelectronic interfaces为题发表在Nature期刊上。
 这种超收缩聚合物(WRAP)由聚乙二醇-α环糊精包合物结晶域与水溶性半结晶聚环氧乙烷域交联组成,通过冷拔工艺使半晶域聚环氧乙烷分子取向,该取向显著提升了聚合物膜遇水后的收缩率,而半结晶域的破坏是实现“收缩变软”的关键,薄膜收缩后杨氏模量可下降三个数量级以上(图1)。此外,整体聚合物分子呈现的微观多孔结构亦赋予了薄膜可集成导电层的能力,且集成工艺兼容图案化工艺,确保了电子器件的高导电率和应变耐受性。
这种超收缩聚合物(WRAP)由聚乙二醇-α环糊精包合物结晶域与水溶性半结晶聚环氧乙烷域交联组成,通过冷拔工艺使半晶域聚环氧乙烷分子取向,该取向显著提升了聚合物膜遇水后的收缩率,而半结晶域的破坏是实现“收缩变软”的关键,薄膜收缩后杨氏模量可下降三个数量级以上(图1)。此外,整体聚合物分子呈现的微观多孔结构亦赋予了薄膜可集成导电层的能力,且集成工艺兼容图案化工艺,确保了电子器件的高导电率和应变耐受性。
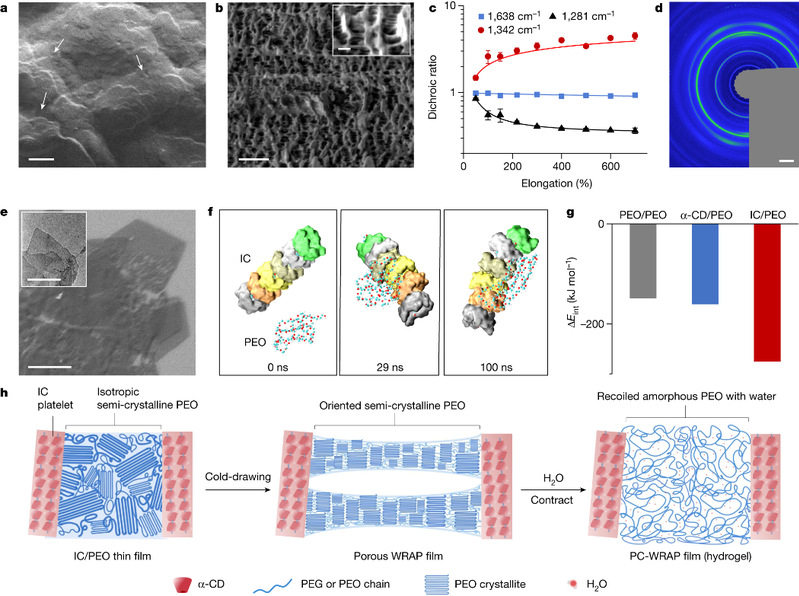
图1. WRAP薄膜的微观结构及超收缩机理。
活体动物实验证明,由该超收缩薄膜制备的自适应生物电子,可以在形状各异的湿润组织表面形成长程鲁棒的生物接口。值得指出的是,即便在连续搏动的心脏表面,仅通过微创胸腔镜手术就可以原位快速完成植入,并实现器件对心外膜的无缝包裹。整个植入手术可在十分钟内完成,且无需做心脏停跳处理。植入后器件在正常搏动和快速性心律失常的心脏表面均能够稳定地监测到高质量的心外膜电信号(图2)。
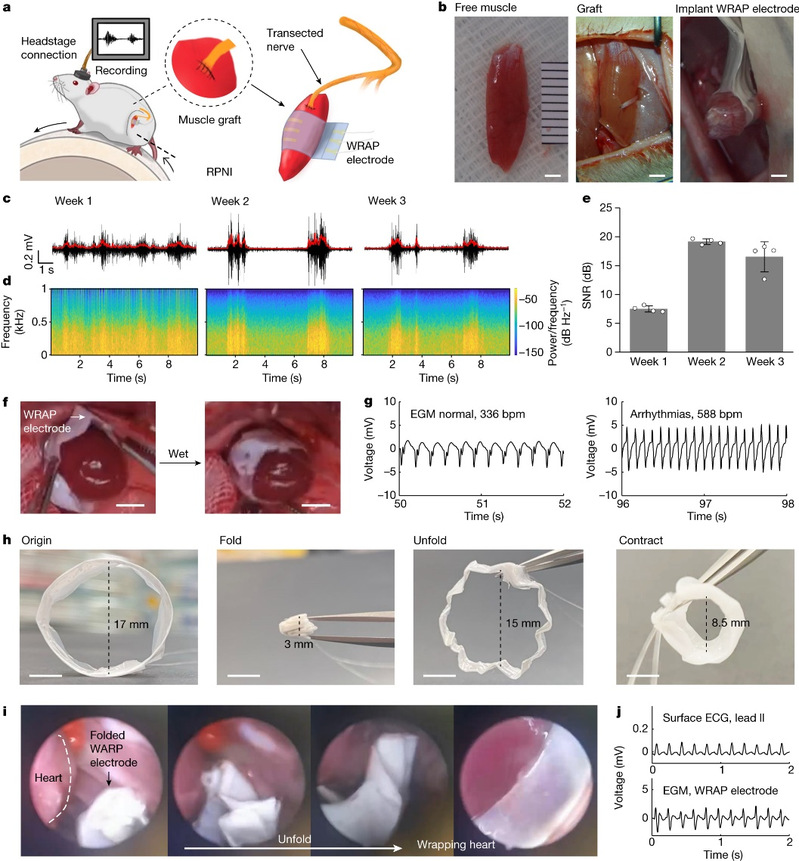 图2. WRAP电极用于再生周围神经界面、心外膜记录和微创植入
图2. WRAP电极用于再生周围神经界面、心外膜记录和微创植入
Yi, J., Zou, G., Huang, J. et al. Water-responsive supercontractile polymer films for bioelectronic interfaces. Nature 624, 295–302 (2023). https://doi.org/10.1038/s41586-023-06732-y
南京医科大学胡本慧ACS Nano: 具有主动降噪功能的感内分析触觉传感器

高灵敏的触觉传感器发展迅速,可以探测人体微弱力信号,对疾病的早期诊断和术后评估有重要意义。然而,高灵敏的传感器对噪声也同样敏感,且传统传感器缺乏感内分析和近感计算能力,阻碍了即时诊断和实时决策的生成。

我校位居独立设置医科大学全国前三,软科2020中国综合大学排行榜第47位
胡本慧教授在《先进材料》上发表最新研究成果助力临床精准抗菌治疗
传染性微生物与宿主细胞之间的斗争对人类的疾病或健康状况起决定作用。迄今,由于抗生素滥用和耐药病原体的增加,细菌感染仍然是全球健康的主要威胁。为了防止抗生素的不利影响,出现了诸如光热和磁热等热消融疗法的替代策略来抑制细菌感染,但热消融过程中靶部位周围产生的过多热量通常会破坏宿主细胞并延长愈合时间,导致无法正常愈合。近日,我校工信院胡本慧教授与新加坡南洋理工大学陈晓东教授课题组深度合作,发现一种基于TRIM(热干扰界面诱导缓解)效应的局部热管理策略,为热消融疗法增加了“剪枝”功能:选择性杀灭细菌并最大程度地减少宿主细胞间内聚力损失,从而实现准确的抗菌治疗。相关成果于2月19日在线发表于《先进材料》(Advanced Materials)(IF=25.809)。

原文链接:
Hu B , Berkey C , Feliciano T , et al. Thermal‐Disrupting Interface Mitigates Intercellular Cohesion Loss for Accurate Topical Antibacterial Therapy[J]. Advanced Materials, 2020, 32
https://onlinelibrary.wiley.com/doi/abs/10.1002/adma.201907030
南京医科大学胡本慧团队:应力松弛机制介导抗脱落无感电极
目前,柔性电极已经广泛应用于便携式医疗、康复、脑机接口和虚拟现实等方面,满足了各种疾病的早期诊断和临床治疗的需求。一个合格的柔性电极应能够长期可靠地连续监测生理电信号,并且不会对人体皮肤造成机械或热限制。许多正在进行的研究致力于开发柔性的导电元件和微结构,以实现较大的可拉伸性和较高的粘附性,从而保证信号记录的可靠性。此外,电极高效的透气性能够保证汗液的及时蒸发,达到生物友好的目的。相较于容易脱水的湿电极,干电极在长期生理电信号监测方面表现出优异的性能。但是干电极获取生理电信号的过程中容易受到复杂的身体活动和各种环境扰动的影响。虽然高粘性和自粘性的干电极拥有强大的界面结合力,能够减少外部影响,但可能会导致皮肤不适甚至刺激,无法循环使用。
针对以上问题,南京医科大学生物医学工程与信息学院胡本慧教授团队设计制备了一种低黏附、抗脱落的透气干电极,通过应力松弛能够消除电极随皮肤拉伸和回弹过程中产生的应力,从而形成稳定的人机界面,用于生理电信号的长期监测及信息交互。该电极以导电聚合物聚(3,4-乙撑二氧噻吩)聚苯乙烯磺酸(PEDOT:PSS)作为主要材料,通过掺杂生物相容性的甘油和聚山梨醇酯获得(命名为DrIE)。甘油和聚山梨醇酯的共掺杂使得PEDOT和PSS之间产生能够减弱静电相互作用的屏蔽效应,进而发生相分离,使电极具有较高的电导率(~130 S/cm)和可拉伸性(应变>90%)。由于增强的可拉伸性、导电性和降低的刚度,DrIE可以与人体皮肤共形贴附,相较于商用的Ag/AgCl电极,在20 Hz到10 kHz的频率范围内表现出更低的界面阻抗。

原文链接:
Tang, W., Zhou, Y., Chen, S. et. al. Delamination-Resistant Imperceptible Bioelectrode for Robust
Electrophysiological Signals Monitoring. ACS Materials Letters 2021, 3,
1385-1393. https://pubs.acs.org/doi/10.1021/acsmaterialslett.1c00353
南京医科大学生物医学工程与信息学院
地址:江苏省南京市江宁区龙眠大道101号学海楼D区602室
电话:025-86869533
邮箱:hubenhui@njmu.edu.cn
感谢您对我们的研究感兴趣。如果您对我们的工作和招聘有任何疑问,请与我们联系。
Thank you for your interest in our research. If you have any questions about our work and recruitment, please contact us.